Nomenclatura de compuestos binarios: PERÓXIDOS
Continuando con la nomenclatura química de compuestos binarios, vamos enfocarnos en el estudio de los Peróxidos (Figura 1). Estos compuestos se caracterizan por presentar un enlace oxígeno-oxígeno. Lo particular de este tipo de compuestos es que el oxígeno presenta el estado de oxidación (- 1). Como podemos ver en la tabla periódica, este elemento actúa generalmente en la naturales con número de oxidación (-2).
¿Qué son los peróxidos?
Estas moléculas pertenecen al grupo de los óxidos, pero se caracterizan por generar un enlace oxígeno-oxígeno que podemos representar de la siguiente forma: -O-O- (O2-2). En particular el oxígeno actúa en estado de oxidación −1.
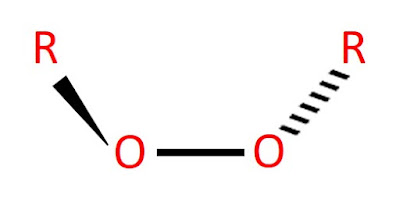
Estos compuestos tienen la estructura ROOR (Figura 2), siendo R cualquier grupo alquilo (reciben este nombre los sustituyentes orgánicos o inorgánicos que se unen a los cuerpos principales de las moléculas).
Sin embargo, como estamos viendo compuestos inorgánicos, los grupos R serán los metales y el hidrógeno. La fórmula general puede representarse así: X2(O2)n. Donde X es el elemento metálico o el hidrógeno y, n es el número de oxidación del metal.
La siguiente figura representa la estructura general de un peróxido:
Figura 2. Estructura de Lewis de un peróxido general.
Para
nombrarlos, utilizaremos las mismas reglas de la nomenclatura que mencioné en el
primer capítulo de química general. Recordemos cuales son:
|
TIPOS DE NOMENCLATURA |
||
|
TRADICIONAL |
SISTEMÁTICA (IUPAC o ATOMICIDAD) |
STOCK |
Nomenclatura TRADICIONAL para identificar peróxidos:
Se escribe primero la palabra peróxido seguida del nombre del elemento que se combina al oxígeno, teniendo en cuenta el estado de oxidación del metal. Los sufijos utilizados siguen la regla de los números de oxidación de los metales involucrados, si dicho metal tiene 4 números de oxidación, se nombran:
peróxido hipo ____oso
peróxido _____oso
peróxido ___ico
peróxido per____ico
Nomenclatura SISTEMÁTICA para identificar peróxidos:
Las reglas para utilizar la nomenclatura sistemática se aplican mediante el uso de un prefijo que indica el
número de átomos de cada elemento. Por ejemplo:
Na2O2 se llama peróxido de disodio
H2O2
se llama peróxido
de dihidrógeno
Nomenclatura STOCK para identificar peróxidos:
Al nombrar un peróxido utilizando la nomenclatura de STOCK, se debe escribir en números romanos el estado de
oxidación del metal o no metal al final del nombre. Se antepone la frase: peróxido de ______ (nro romano) Veamos los ejemplos:
U(O2)2 se llama peróxido de uranio (IV)
Mn2(O2)6 se llama peróxido de manganeso (VI)
¿Cómo nombrarías a estos compuestos?
Ahora
pongamos en práctica lo aprendido. No olvidar tener la tabla periódica a mano
para poder ver los estados de oxidación.
Referencias
Soy Licenciada en Ciencias Biológicas y tengo un PhD en Química Biológica. Escribo esta página basada en mi experiencia como docente e investigadora y utilizo fuentes de información confiables para la redacción de los artículos que dejo a continuación: