Leyes de los Gases
📐📚Leyes de los Gases. Gases Ideales.📏📚
En esta ocasión me gustaría explicar un tema que interesa a muchos estudiantes de Química General e Inorgánica y que suele ser un buen ejemplo del tratamiento de muchas variables dentro de un mismo sistema.
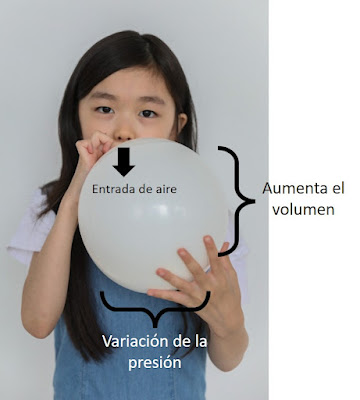
Pensemos en el siguiente ejemplo, ¿qué pasa cuando inflamos un globo?
El aire que introducimos, provoca que el globo se infle y su superficie se estire hasta un cierto límite, que será, cuando el globo estalle.
¿Qué le sucedió al sistema?
Se introdujo aire y el sistema respondió a esa perturbación variando su Masa,
Presión y Volumen. Esto significa que estamos contemplando al menos 3 variables
que están de alguna manera relacionadas y determinan el estado del sistema.
Variables del sistema
Ahora pensemos en un neumático de un auto que recorre por ejemplo, 100 km.
Si se mide la presión de dicho neumático antes y después de haber recorrido
cierta distancia, vamos a notar que la masa no ha variado, no se perdió masa
del neumático, pero sí notaremos que la presión varió. Esto es el resultado de
otra variable más, la Temperatura (Figura 1).
Figura 1. Un neumático de un vehículo es el ejemplo ideal de las variables de un sistema gaseoso.
En resumen, hay muchas variables en juego:
- Masa
- Presión
- Volumen
- Temperatura
Todas estas variables generan una perturbación en el sistema. Para entenderlas, se han desarrollado leyes surgidas de la experiencia que nos permiten comprender la relación entre presión y volumen a temperatura constante o la relación entre volumen y temperatura a presión constante.
Cabe aclarar que es necesario dejar una
variable constante para poder simplificar el sistema. De no contar con una constante, sería muy complicado
entender qué parámetro afecta a otro si todo está variando al mismo tiempo.
Veamos entonces el resultado de las experiencias realizadas, que dieron
lugar al establecimiento de las Leyes de los Gases:
Ley de Boyle-Mariotte
La relación matemática que existe entre la presión y el volumen a una masa fija de gas y a temperatura constante, fue descubierta por Robert Boyle en 1662.
La siguiente tabla muestra como varía la presión en función del volumen de una masa constante de gas (10 g) a una temperatura constante (25°C):
De este análisis de datos podemos deducir que para una masa fija de gas a
una temperatura constante obtenemos una gráfica que corresponde a una
hipérbola, por lo tanto, P x V = constante. Es decir que el volumen ocupado por
una determinada masa de gas a una dada temperatura, es inversamente
proporcional a la presión y lo mismo al revés. La presión ejercida por una masa
de gas es inversamente proporcional a su volumen.
La fórmula sería:
Donde k (m,T) es la constante de proporcionalidad a una masa de gas
constante y temperatura constante.
Ley de Charles y Gay-Lussac
Charles y Gay Lussac definieron las leyes de los gases cuando el volumen es constante. En este estado del sistema, la presión de una masa fija de un gas dado es directamente proporcional a la temperatura medida en Kelvin.
Si usamos los mismos datos que antes, podemos ahora analizar la relación entre el
volumen de una masa de gas y su temperatura, a presión constante:
Como podemos ver en el gráfico, el volumen aumenta linealmente con la temperatura.
Si hiciéramos este experimento con cualquier gas, y ponemos como valor de
volumen 0°C, obtenemos siempre el valor de T=-273,15 °C; es decir…¡¡la
temperatura más baja posible!!
Este corrimiento implica un cambio en la escala de temperaturas: el nuevo
valor 0 corresponde entonces -273,15 °C y cualquier temperatura ahora simbolizada
T será así:
T = T°C +273,15
Esta temperatura T se denomina temperatura absoluta o Kelvin
y se denota con K. Por ejemplo, 10°C equivalen a calcular 10°C +
273,15= 283,15 K.
Convirtiendo entonces todos los valores usados en la tabla del gráfico a K
y volviendo a graficar, obtenemos:
Figura 6. Relación lineal entre el Volumen (dm3) y la Temperatura en Kelvin (K).
Finalmente vemos que existe una relación de proporcionalidad directa
entre el volumen y la temperatura en la escala Kelvin. Esto facilita mucho los
cálculos en los que estas magnitudes están involucradas. Por lo tanto, a modo
de conclusión, la relación entre la temperatura y el volumen de una masa de gas
constante es la siguiente:
Esta relación implica que el volumen de un gas disminuye al disminuir T y debería anularse a T =0. Esto, por lo tanto, sugiere que el 0 en la escala de Kelvin es la menor temperatura posible.
Una temperatura inferior
implicaría un volumen negativo y eso no tiene
sentido físico. Recordemos que por más que matemáticamente se pueda calcular
una variable, estamos sujetos a las
leyes físicas.
Figura 8. Cuando la temperatura aumenta, el volumen del sistema aumenta. Cuando la temperatura baja, el volumen del sistema disminuye.
Por último, si se obtienen experimentalmente valores de Presión y se grafican
en función de la temperatura absoluta (a masa y volumen constantes) obtenemos que la presión es directamente proporcional a la temperatura. Gráficamente:
Figura 9. La presión es directamente proporcional a la temperatura.
Ecuación General de los Gases
Al combinar estas observaciones en una sola ecuación (ver el artículo Ecuación General de los Gases Ideales) que resuma el comportamiento de los gases, obtenemos:
Donde podemos ver la relación inversamente proporcional entre la presión y el volumen y la relación directamente proporcional entre la presión y la temperatura así como entre la temperatura y el volumen.
Aquí vemos también que la n
representa la masa del gas, que se expresa en moles y R que es la constante
universal de los gases ideales que siempre es este valor: 0,082 (atm x L / K
x mol).
Referencias
Soy Licenciada en Ciencias Biológicas y tengo un PhD en Química Biológica. Escribo esta página basada en mi experiencia como docente e investigadora y utilizo fuentes de información confiables para la redacción de los artículos:
1. Temas de Química General. M. Angelini. Ed Eudeba, 2007
Hasta
aquí el contenido de hoy. Espero que te sirva y puedas usarlo para estudiar.
¡¡No
olvides comentar y consultar lo que no entiendas!!